Duetila oksalato
kemia kombinaĵo
(Alidirektita el Etila oksalato)
| Duetila oksalato | |||
 | |||
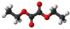
| Plata kemia strukturo de la Duetila oksalato | |||
 | |||
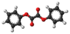
| Tridimensia kemia strukturo de la Duetila oksalato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 95-92-1 | ||
| ChemSpider kodo | 6998 | ||
| PubChem-kodo | 7268 | ||
| Merck Index | 15,3142 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo | ||
| Molmaso | 146,142 g·mol−1 | ||
| Denseco | 1,076g cm−3 | ||
| Fandpunkto | −41 °C | ||
| Bolpunkto | 185 °C[1] | ||
| Refrakta indico | 1,4101 | ||
| Ekflama temperaturo | 75 °C | ||
| Memsparka temperaturo | 410 °C[2] | ||
| Solvebleco | Akvo:reakcias | ||
| Mortiga dozo (LD50) | 387 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R22 R36 | ||
| Sekureco | S23 | ||
| Pridanĝeraj indikoj | |||
| Danĝero | |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P270, P280, P301+312, P305+351+338, P330, P337+313, P501[3] | ||
(25 °C kaj 100 kPa) | |||
Duetila oksalato aŭ C6H10O4 estas organika komponaĵo apartenanta al la familio de la etilaj esteroj, rezultanta el kombinado de okzalata acido kaj etanolo, senkolora likvaĵo, iomete pli densa ol la akvo kaj solvebla en etanolo, duetila etero, acetono kaj aliaj ordinaraj solvantoj. Duetila oksalato estas uzata en kemiaj sintezoj kaj en la fabrikado de parfumoj kaj farmaciaĵoj.
Sintezoj
redaktiSintezo 1
redakti- Preparado per agado de okzalata acido kaj etanolo:
Sintezo 2
redakti- Preparado per traktado de okzalata anhidrido kaj etanolo:
Sintezo 3
redakti- Preparado per reakcio de etila klorido kaj okzalata acido:
Sintezo 4
redakti- Preparado per interagado de etila klorido kaj natria okzalato:
Sintezo 5
redakti- Preparado per transesterigo inter etila acetato kaj fenila okzalato:
Sintezo 6
redakti- Preparado per acida transesterigo inter etila benzoato kaj okzalata acido:
Sintezo 7
redakti- Preparado per alkohola transesterigo inter dimetila okzalato kaj etanolo:
Reakcioj
redaktiReakcio 1
redakti- Hidrolizo de la duetila oksalato:
Reakcio 2
redakti- Sapigo de la duetila oksalato:
Reakcio 3
redakti- Reakcio per acida transesterigo kun formiata acido:
Reakcio 4
redakti- Reakcio per alkohola transesterigo kun fenolo:
Reakcio 5
redakti- Reduktigo de la etila okzalato:
Reakcio 6
redakti- Reakcio kun NH3:
Reakcio 7
redakti- Reakcio kun HCl:
Literaturo
redaktiReferencoj
redakti🔥 Top keywords: Vikipedio:ĈefpaĝoSpecialaĵo:SerĉiCarles Puigdemont i CasamajóEsperantoSpecialaĵo:Lastaj ŝanĝojDua MondmilitoVikipedioUzanto:DominikHelpo:EnhavoVikipedio:KontaktojVikipedio:MalgarantioJapana lingvoVikipedio:DiskutejoVikipedio:AktualaĵojPortalo:KomunumoBenjamin HenrichsRobin KochUsonoAŭstralioMaximilian MittelstädtRobert AndrichSerĉilo-optimumigoVikipedio:Forigendaj artikolojBlanka Domo (Vaŝingtono)Das doppelte LottchenMarco PicassoMilena VelbaChristian GünterVikipedio:EnkondukoNiclas FüllkrugKomputila terminaloDeniz UndavArmel Bella-KotchapYoussoufa MoukokoWest Ham UnitedPortoMalpleno de CassiniSeksumadoVikipedio:Bonvenon al Vikipedio