חומצה פורמית
חומצה פורמית (באנגלית: Formic acid) או חומצת נמלים או חומצה מתאנואית (באנגלית: methanoic acid) היא תרכובת אורגנית חומצית בעלת pKa של 3.75 ומסתה המולרית היא 46 גרם/מול. זוהי החומצה הקרבוקסילית הפשוטה ביותר.
 | |
 | |
| שם סיסטמטי | Methanoic acid |
|---|---|
| שמות נוספים | חומצת נמלים |
| כתיב כימי | CH₂O₂ |
| מסה מולרית | 46.0254 גרם/מול |
| מראה | נוזל שקוף מעלה אדים |
| מספר CAS | 64-18-6 |
| צפיפות | 1.22 גרם/סמ"ק |
| מצב צבירה | נוזל |
| מסיסות | מסיס לחלוטין במים |
| טמפרטורת היתוך | 8.4 °C 281.55 K |
| טמפרטורת רתיחה | 100.8 °C 373.95 K |
| מקדם שבירה | 1.3714 |
| חומציות | pKa= 3.744 pKa |
| נקודת הבזק | 69 °C 342.15 K |
| נקודת התלקחות | 601 °C 874.15 K |
| אנתלפיית התהוות סטנדרטית | −409.19 קילוג'ול למול |
| אנטרופיה מולרית תקנית | 131.8 ג'ול למול למעלה |
| LD50 | 700 (חולדות, דרך הפה) מ"ג לק"ג |
| NFPA 704 | |


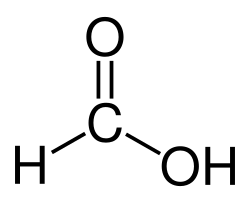
הנוסחה הכימית לחומצה פורמית היא HCOOH או CH2O2, כלומר, מימן המחובר לקבוצת קרבוקסיל (COOH) ונמנה ביחד עם חומצות קרבוקסיליות אחרות (כגון חומצה אצטית: CH3COOH, חומצה פרופנואית: CH3CH2COOH ועוד).
בטבע, החומצה הפורמית נמצאת בעקיצות ונשיכות חרקים מקבוצת הדבוראים (הימנופטרה) שכוללת דבורים ונמלים. נמלים מייצרות את החומצה הפורמית מסיבות הגנתיות והתקפיות. חומצה פורמית היא גם אחד החומרים הפעילים בקוצי רוב מיני הסרפד. כאשר נדקרים מסרפד היא הגורם לצריבה בעור.
החומצה הפורמית היא תוצר שרפה של מנועי מתאנול ואתאנול כאשר מעורבבים עם בנזין.
מקורו של שם החומצה במילה הלטינית לנמלה: Formica.
היסטוריה
עריכהבמאה ה-15, כמה אלכימאים היו מודעים לכך שקיני נמלים פולטים אדים חומציים. הנטורליסט ג'ון ריי הבחין בשנת 1671 שברזל ועופרת עברו קורוזיה באוויר שמעל קיני נמלים. בזקוק בקיטור של הנמלים התקבל נוזל שקוף שתקף עופרת. זקוק יבש של המלח שהתקבל נתן חומצה חזקה.
החומצה הפורמית סונתזה לראשונה על ידי הכימאי הצרפתי לואי ז'וזף גה-ליסאק מחומצה ציאנידית (HCN). מאוחר יותר, ב-1855 כימאי צרפתי אחר פיתח שיטה חדשה לסינתוז חומצה פורמית מפחמן חד-חמצני, שיטה דומה לזו שמשתמשים כיום.
כימיה
עריכהחומצה פורמית היא החזקה מכל החומצות האורגניות הלא-מותמרות. החומר עובר פירוק עצמי על ידי איבוד מים, מימן או ריאקציית חמצון-חזור דו-מולקולרית
חומצה פורמית תתפרק בשעור ניכר גם בטמפרטורת החדר. מים (כולל שאריות מים מריאקציות הפירוק עצמן) יעכבו את הפירוק.
הפקה
עריכהכמויות גדולות של חומצה פורמית נוצרות כתוצרי לוואי של יצירת חומרים אחרים (כגון חומצה אצטית).למרות זאת, הכמויות שנוצרות בתגובות אלו אינן מספיקות לביקוש החומצה הפורמית כיום.בגלל זה, ישנו יצור בלעדי של חומצה פורמית:
כאשר מתאנול (CH3OH) ופחמן חד-חמצני (CO) מעורבבים ביחד בסביבה בסיסית, נוצר החומר מתיל-פורמט (HCOOCH3) לפי המשוואה הבאה:
בתעשייה, הראקציה הזאת מתרחשת במצב נוזלי, ב-80 מעלות צלזיוס ו-40 אטמוספירות.
הידרוליזה של המתיל-פורמט יגרום לתגובה הבאה וליצירת חומצה פורמית:
כיוון שהתהליך הזה דורש כמות רבה של מים, חלק מהתעשיינים מעדיפים תהליכים עקיפים:תגובה עם אמוניה ליצירת פורממיד (HCONH2) ואז, ראקציה עם מים וחומצה גופרתית ליצירת החומצה הפורמית:


גם לתהליך זה בעיות משל עצמו בגלל תוצר האמוניום סולפט.
שימושים
עריכהעד שנות ה-60 החומצה הפורמית הייתה בעלת שימושים מעטים בלבד. כיום משתמשים בה כחומר אנטיבקטריאלי, כחומר משמר במזון לחיות משק וכחומר הדברה כנגד סלמונלה וטפילים של דבורים.
לחומצה הפורמית גם שימוש משני בתעשיית הטקסטיל. בתעשיית הכימיה האורגנית הסינתטית, משמשת החומצה הפורמית כמקור ליון הידרידי (- H). במעבדה, החומצה הפורמית משמשת כמקור לפחמן חד-חמצני שנוצר בערבוב של החומצה עם חומצה גופרתית.




